非小细胞肺癌术后辅助免疫治疗
术后辅助化疗是早期(IB-ⅢA)非小细胞肺癌(NSCLC)患者标准疗法,但5年生存率仅改善约5%。随着免疫治疗在围手术期NSCLC患者临床研究阳性结果的发布,免疫治疗提供了新的辅助治疗模式,可显著提高早期肺癌长期生存率。全球已有两大免疫检查点抑制剂获批用于非小细胞肺癌术后辅助免疫治疗,分别是阿替利珠单抗和帕博利珠单抗,下面我们介绍相关临床研究。
阿替利珠单抗
1 ► 2021年10月16日,美国食品与药品监督管理局(FDA)批准阿替利珠单抗用于肿瘤细胞PD-L1表达阳性(≥1%)、Ⅱ期~ⅢA期非小细胞肺癌(NSCLC)患者接受手术和铂类药物化疗后的辅助治疗。
2 ► 2022年3月16日,中国国家药品监督管理局(NMPA)正式批准阿替利珠单抗用于PD-L1肿瘤细胞(TC)表达≥1%、经手术切除及以铂类为基础化疗后的II-IIIA期非小细胞肺癌(NSCLC)患者的辅助治疗。而这是中国获批的首个NSCLC术后辅助免疫治疗适应证。
这一批准是基于IMpower010研究,是一项随机、多中心、开放标签的III期研究,该研究比较阿替利珠单抗和最佳支持治疗(BSC)对辅助化疗后完全切除的IB-IIIA期NSCLC的疗效和安全性。主要研究终点是无病生存(DFS)率,次要疗效终点为意向治疗(ITT)人群的总生存(OS)率和安全性结局,根据PD-L1肿瘤细胞(TC)表达<1%、1%~49%和≥50%进行分层。
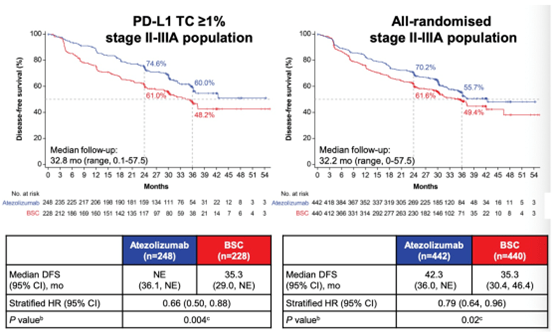
图1 IMpower010 研究中Ⅱ-ⅢA 期患者的 DFS(引自文献2)
数据显示,PD-L1 TC≥1% II-IIIA期患者中,阿替利珠单抗辅助治疗对比BSC,2年DFS率为74.6% vs 61.0%,3年DFS率为60.0% vs 48.2%,中位随访32.8个月的DFS期显著延长,分别为尚未达到 vs 35.3个月(DFS HR 0.66;95%CI:0.50-0.88)。
所有随机化Ⅱ-ⅢA期NSCLC患者中,阿替利珠单抗辅助治疗对比BSC,2年DFS率为70.2% vs 61.6%,3年DFS率为55.7% vs 49.4%,中位随访32.2个月的DFS显著延长,分别为42.3 vs 35.3个月(DFS HR 0.79;95%CI :0.64-0.96)。

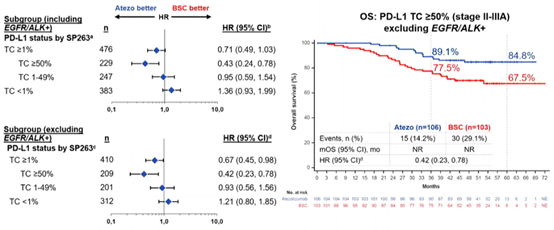
图2 3 IMpower010 研究中 PD-L1 TC≥1% 和不同 PD-L1 表达水平的 OS(引自文献2)
2022 年最新更新的 OS 数据显示:中位随访 46 个月后,PD-L1 TC≥1% II-IIIA期患者中,阿替利珠单抗辅助治疗对比BSC,两组中位 OS 尚未达到,OS 曲线区分明显(OS HR 0.71;95%CI:0.49-1.03)。
从生物标志物来亚组分析发现,OS 获益主要集中在 PD-L1 阳性患者,特别是 PD-L1 TC≥50% 的患者中。高表达TC≥50%(除EGFR/ALK+外)患者3 年 OS 率 89.1% vs 77.5%,5 年 OS 率 84.8% vs 67.5%。(OS HR 0.42;95%CI:0.23-0.78)

图4 IMpower010 研究中不良反应概率(引自文献2)
在安全性方面,两组的3级或4级不良事件发生率相似,阿替利珠单抗组和BSC组分别为22.0%(495/108)和11.5%(495/57)。两组的5级AE发生率为分别为 0.8%和0.6%。
帕博利珠单抗
1 ► 2023年1月26日美国食品药品监督管理局(FDA)批准帕博利珠单抗用于IB期(T2a≥4 cm)、II期或IIIA期非小细胞肺癌(NSCLC)患者肿瘤切除和铂类化疗后的辅助治疗。
这一批准是基于KEYNOTE-091研究,是一项随机、多中心、开放标签的III期研究,纳入的患者既往未接受过新辅助放疗或化疗。该研究比较帕博利珠单抗与安慰剂(1:1)联合或不联合辅助化疗作为手术切除(肺叶切除术或肺切除术)后IB-IIIA期NSCLC患者辅助疗法的疗效和安全性差异。主要研究终点是为整体人群的及 PD-L1 TPS≥50% 的患者的无病生存(DFS)率。次要终点包括总生存期(OS)、肺癌特异性生存期(LCSS,从随机化到死亡日期的时间)。
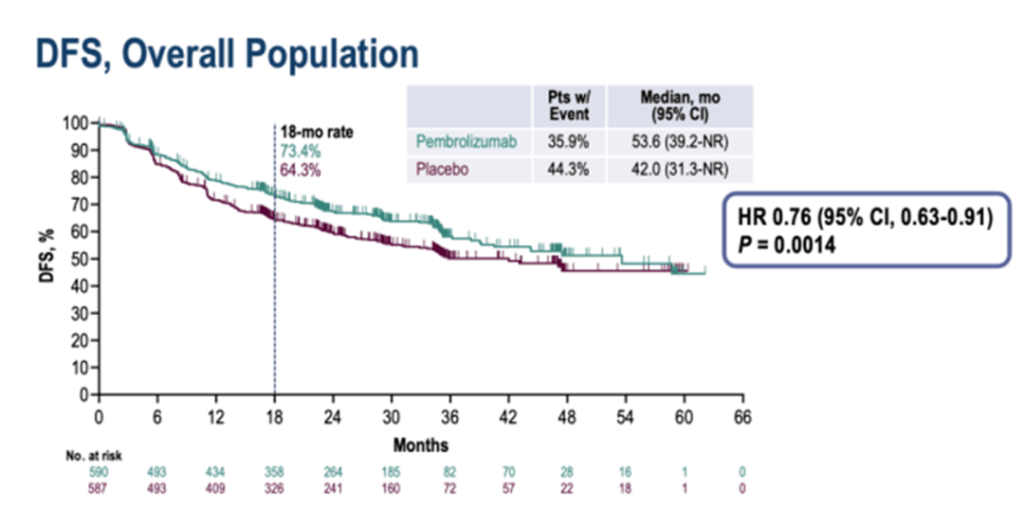
图5 KEYNOTE-091研究中总体人群的DFS (引自文献3)
数据显示,总人群中,帕博利珠单抗组和安慰剂组的中位DFS分别为53.6个月 vs 42.0个月(DFS HR=0.76, 95%CI 0.63-0.91), P=0.0014。

图6 KEYNOTE-091研究中PD-L1表达≥50%人群的DFS(引自文献3)
亚组分析显示,在PD-L1 TPS≥50%人群中,帕博利珠单抗对比安慰剂组的中位DFS未达到(DFS HR=0.82, 95%CI 0.57-1.18), P=0.14;

图7 KEYNOTE-091研究中DFS亚组分析(引自文献3)
PD-L1表达TPS 1-49%人群(DFS HR=0.67, 95%CI 0.48-0.92);PD-L1表达TPS<1%人群(DFS HR=0.78, 95%CI 0.58-1.03);亚组分析结果并未像在晚期NSCLC中一样,随着PD-L1表达的提升,帕博利珠单抗疗效随之增加。
研究者回应这可能是由于安慰剂组的疗效超出预期,以及 PD-L1 TPS≥50% 人群的样本量相对较小,导致两组没有统计学显著性差异。对于这部分人群,还需要后续更长随访和疗效分析确定 DFS 是否存在差异。
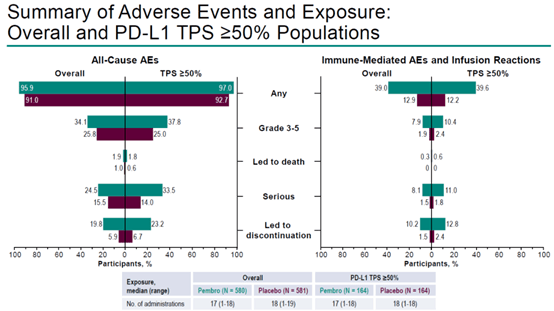
图8 总人群和PD-L1 TPS≥50%人群的全因不良事件、免疫相关不良事件和输液反应(引自文献3)
在安全性方面,两组的≥3级不良事件发生率相似,帕博利珠单抗组和安慰剂组患者发生率为34.1%和25.8%。两组的严重不良事件发生率分别为24.5%和15.5%。
综上所述,免疫检查点抑制剂在早期的 NSCLC 术后辅助治疗中效果是确切的,随着靶向和免疫治疗在围手术期患者中的获批应用,免疫疗法也将使得更多患者受益。
参考文献:
1.PL03.09 – IMpower010:Overall Survival Interim Analysis of a Phase III Study of Atezolizumab vs Best Supportive Care in Resected NSCLC.2022 WCLC.
2.Felip E, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial [published correction appears in Lancet. 2021 Sep 23;:]. Lancet. 2021;398(10308):1344-1357. doi:10.1016/S0140-6736(21)02098-53.
3.Antonio Passaro. Invited Discussant 1529MO, 930MO and 933MO. 2022 ESMO.
4.O’Brien M, Paz-Ares L, Marreaud S, et al. Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol. 2022;S1470-2045(22)00518-6. 2. S. Peters, B. Besse, S.I. Marreaud, et al. PD-L1 expression and outcomes of pembrolizumab and placebo in completely resected stage IB-IIIA NSCLC: Subgroup analysis of PEARLS/KEYNOTE-091. 2022 ESMO. Abs 930MO.


.png)
.png)

